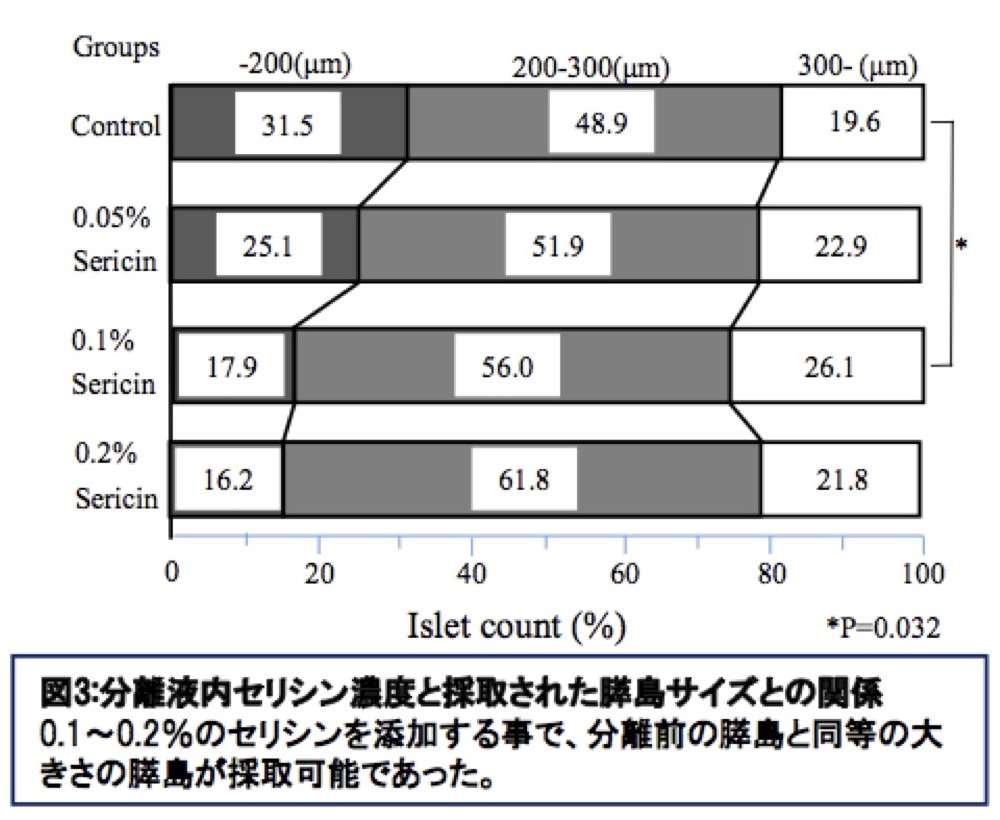
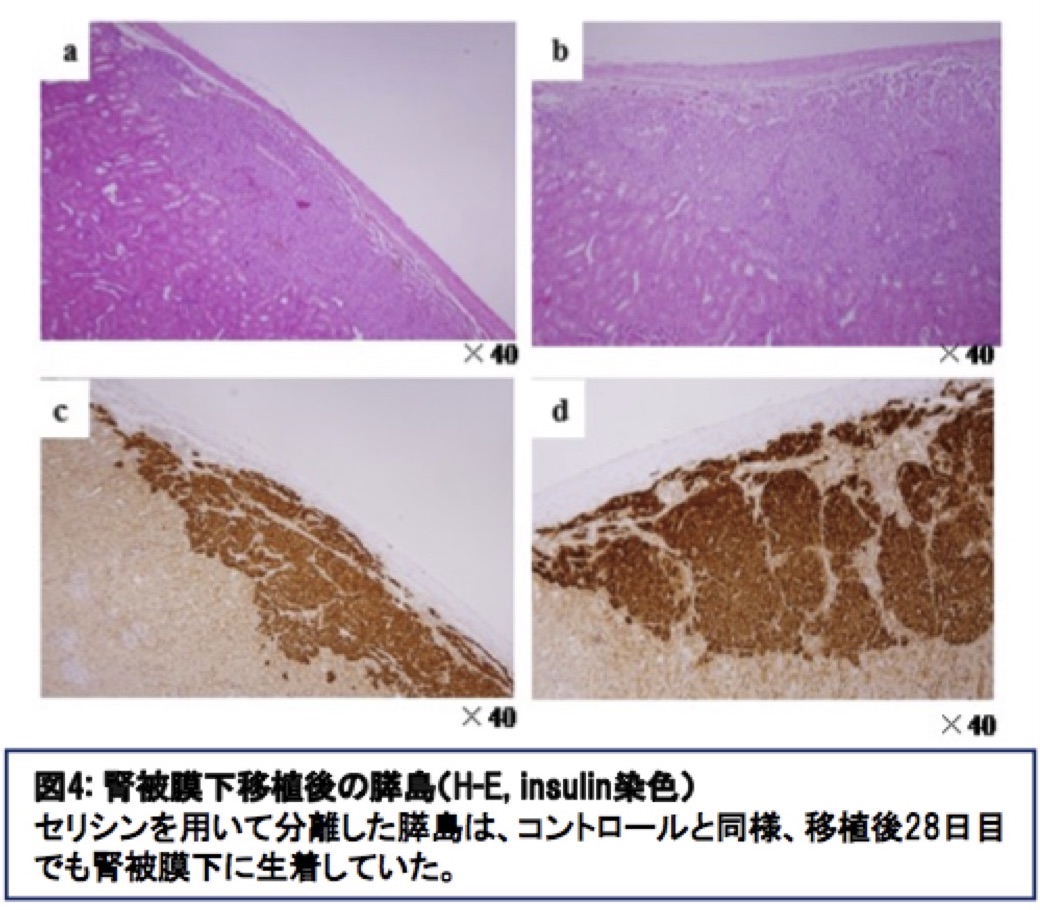
第一外科学教室は食道、胃、大腸などの消化管、肝臓、胆道、膵臓、ならびに乳腺の疾患に対して手術を中心とした治療にて病気が完治することを目指しております。その中で特に生命を脅かす疾患のがんは最大の難的であり、日々治療の進歩に心掛けています。また最近では1型糖尿病の治療法として、膵ランゲルハンス島(膵島)移植が本邦において承認されたものの、煩雑な手技が必要であり、簡便な方法が求められています。
現在、大きく4つの柱、
- (1)胃癌に対する浸潤、転移機構の解明
- (2)大腸癌に対する浸潤、転移機構の解明ならびに新規治療の開発
- (3)乳癌に対する内分泌治療効果予測診断の開発
- (4)膵臓ラ島の分離、移植法の開発
について行っています。ひいては近い将来、患者さんに応用できることを目標にしています。